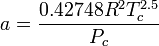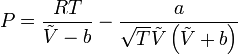Caro Sirius, secondo me ti sbagli!!!
Il problema va risolto (come suggerito) utilizzando Redlich-Kwong.
Semplicemente ci troviamo nella "zona" sotto la campana (diagramma PV), in questo caso l'equazione cubica considerata ci dà in output 3 soluzioni reali e distinte, qlla centrale và eliminata in qnto è relativa ad uno stadio intermedio instabile. La soluzione numericamente più piccola corrisponde al volume specifico del liquido, qllo maggiore al volume specifico del vapore.
I miei calcoli :a= 6,46 [Pa*((m^3)/mol)^2 * K^0.5]
b= 2,968x10^-5 [m^3/mol]Risolvendo la cubica con la TI-89 ho ottenuto 3 valori (li riporto tutti per completezza):
6,385x10^-5 [m^3/mol] ; 1,259x10^-4 [m^3/mol] ; 2,829x10^-4 [m^3/mol].
Qndi il
volume specifico del liquido sarà : 6,385x10^-5 [m^3/mol]Qllo del
vapore: 2,829x10^-4 [m^3/mol](non meravigliatevi se non esiste una grande differenza tra i volumi specifici del liquido e del vapore, ciò è dovuto al fatto ke siamo a T e P elevate, non dico prossime al punto critico ma quasi)
va bè poi da qui la strada è relativamente semplice:
moli CO2 fase vapore =0,03 [m^3] / 2,829x10^-4 [m^3/mol] =
106,045 [moli]moli CO2 fase liquida = 469,851 [moli]in tot abbiamo qndi 575,896 moli di CO2 , che corrispondono a 25,34 KgSpero di essere stato chiaro, e soprattutto di aver fatto bene... ihih

Aspetto conferme da voi altri ke svolgerete l'esercizio
Ciao